現在、週2日の業務委託で行っている訪問鍼灸・マッサージの患者さまの中に、パーキンソン病の患者さまがいます。お一人は孤発性といわれる、いわゆる普通のパーキンソン病です。もう一人は全体の10%以下とされている家族性パーキンソン病です。
前者の孤発性パーキンソン病に比べ、後者の家族性パーキンソン病の解明に関しては、病因となる遺伝子の発見などが進んでいます。その家族性パーキンソン病である、もう一人の患者さまの鍼治療の目的は痛みの軽減です。8月後半に発生した右大腿部前面近位の強い痛みについては、中間広筋を中心にした大腿四頭筋への施術により、9月中旬には概ね痛みは取れましたが、現在の主訴である強い側弯を伴う右腰痛については苦戦しています。パーキンソン病で現れるドパミンの問題は、中枢神経からの痛みの抑制も関係しており(参考「ドーパミンの鎮痛作用」)、簡単な話でないのは間違いありませんが、少しでも軽減したいと試行錯誤しています。
一方、家族性パーキンソン病に対する理解不足は明らかだったため、何はともあれ「知ること」を目的に、『パーキンソン病 -進化する診断と治療』という専門誌に挑戦することにしました。
なお、その特集は【座談会】【基礎】【診断】【治療】の4つに分かれています。今回のブログはその中の【座談会】が対象になります。
【座談会】は「何故、減るのか」に関して、研究テーマを3つに分けて紹介しています。ブログではこの3つを取り上げ、続いてDMT(disease modifying therapy:疾患修飾療法)、発症前診断・発症前治療の課題、弧発性パーキンソン病への展開の4つについて書いています。
内容は本文から抜き出したものを列挙するだけというものですが、それぞれに関連して見つけたサイト(記事)を添付させて頂きました。そして、最後に、分かったことをまとめ、あらたな宿題を明記しました。
1.αシヌクレインの凝集
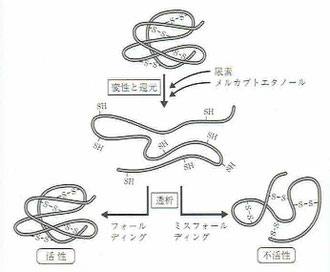
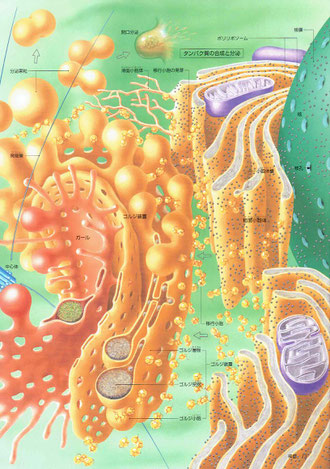
上記の表と図は、『タンパク質の一生』という本から持ってきたものです。(参考「悪玉タンパク質」)
表内の原因タンパク質を見ると、アルツハイマー病のアミロイドβタンパク質、プリオン病(BSE)のプリオンが比較的有名だと思いますが、αシヌクレインは家族性パーキンソン病の原因タンパク質とされています。つまり、αシヌクレインは、アルツハイマー病でいえば、アミロイドβタンパク質と同じ位置づけということになります。
フォールディング異常(ミスフォールディング)とは、製品で考えれば製造ミスです。不活性とは不良品ということです。右上の図の右下の絵は[不活性]となっており、上方に描かれた元の形のようになっていません。これがミスフォールディングです。
ミスフォールディングによって不活性となったタンパク質は凝集する傾向があります。そして、凝集したタンパク質は細胞にとって非常に有害です。なお、フォールディング異常の原因とされているのは、熱、細菌感染、炎症、活性酸素、紫外線、飢餓、低酸素状態などのストレスとされています。
●αシヌクレインというタンパク質が異常化して、これが毒性を発揮するのではないか。
●αシヌクレイン(タンパク質凝集体であるレビー小体の主成分と考えられている)は細胞から細胞に伝播することが分かってきた。
●αシヌクレインによる線維形成と細胞毒性は3種類(フィブリル、オリゴマー、リボン)あると言われている。つまり、αシヌクレインが蓄積したときの構造によって毒性が違う可能性があり、毒性の少ないαシヌクレインに変化させるという治療戦略も考えられる。
●パーキンソン病で最初にαシヌクレインの病理が出てくる脳幹の下部にある迷走神経背側核(下図参照)は腸管をしており、その腸管を調べてみると腸管にもαシヌクレインの塊があることがわかってきた。したがって、最初に腸管にαシヌクレインの塊ができて、迷走神経の線維を伝って脳幹下部の迷走神経背側核に病理が出現するのではないか、すなわち、パーキンソン病は腸から始まるのではないかという面白い考え方が、最近提唱されている。
●Parkin変異の患者でαシヌクレインが蓄積しているのは、ほとんどが高齢者である。通常、20歳代でパーキンソン病を発症してしかるべきなのに、60歳代で発症しているケースがある。これはαシヌクレインがParkinのマイトファジーに保護的に働いている可能性があり、一方的にαシヌクレインを悪者扱いすることは正しくないかもしれない。しかしながら、αシヌクレイン遺伝子がduplicaton、triplicationになるとパーキンソン病を発症する。また、αシヌクレインの蓄積が細胞死に結びつくことは多くのエビデンスがあり、αシヌクレインをDMTのターゲットの第1候補になるだろう。
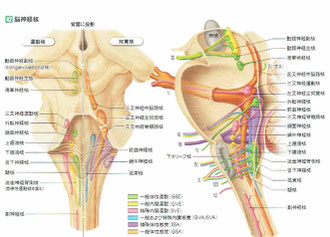
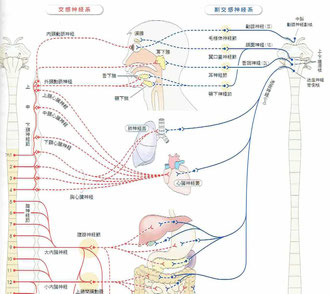
上記の2つの絵はいずれも「人体の正常構造と機能」からのものです。(クリックすると拡大されます)。
左は脳幹部に存在している脳神経核の絵ですが、迷走神経背側核は下部の延髄に、疑核(ピンク色)と舌下神経核(緑色)の間に存在しています。色は黄色なので、その働きは「一般内臓運動(GVE)」ということです。一方、右の絵では迷走神経背側核が関係している臓器が確認できます。核は右上にあり、多くの内臓の運動に関わっていることが分かります。
2.ミトコンドリアの品質管理障害

「エネルギープラント」とも言うべきミトコンドリアは、もともとは別のバクテリアで、およそ16億年前、酸素を使わない単細胞生物と共生を始めたと考えられています。そのミトコンドリアはエネルギー生産の過程で、危険な活性酸素を放出してしまう宿命を負ってしまいました。
活性酸素は反応性が強く、周囲の物質をボロボロにしてしまう危険性を孕んでいますが害ばかりではありません。
外部からの異物を殺菌するのに利用されたり、古くなったタンパク質を壊すのに使われたり、酸化力の強い刺激で細胞を元気にしたりする作用も持っています。このように、危険なはずの活性酸素が利用されているのは、私たちの体に活性酸素を無毒化する酵素が数多く備わっているからです。逆にいうと、進化の過程において活性酸素という強い毒物を無毒化できるようになったということです。
出版:新潮文庫
●ミトコンドリアの品質管理の障害により、異常ミトコンドリアが毒性を発揮するのではないか。
●パーキンソン病の分子病態に関して、非常に注目されているのはミトコンドリアの品質管理障害。家族性パーキンソン病の病因遺伝子としてParkinとPINK1という分子があり、これらが欠損するとパーキンソン病になることが分かっている。そして、この2つのタンパク質は傷害を受けたミトコンドリアを処理するときにも非常に重要な役割を果たしていることが分かってきた。すなわち、ミトコンドリアが傷害を受けると、これら2つの分子の働きによってそのミトコンドリアオートファジーにより分解処理される。これをマイトファジーと言うが、それによって、傷害を受けて働けなくなったミトコンドリアが処理される。一方、PINK1、Parkinが変異を起こすパーキンソン病ではマイトファジーが機能しなくなり、傷害を受けたミトコンドリアが処理されずに残るため、活性酸素などを放出し細胞死を引き起こすという考え方がある。この知見は培養細胞を主とした実験ではあるが、かなり確かな事実として受け入れられてきている。
●新しいパーキンソン病遺伝子として、CHCHD2遺伝子がある。この分子によってミトコンドリア機能とパーキンソン病の新たな関係が明らかになるのではないかと注目されている。
●CHCHD2が電子伝達系の酸素活性に影響を与えることは、マウスやショウジョウバエの研究から多分間違いないという所まではきており、そのミトコンドリアが一次的に傷害を受けるとドパミン神経細胞死につながる可能性を考えている。
●CHCHD2はミトコンドリアの異常の問題とαシヌクレインによる問題とを結びつけるキーファクターになるかもしれない。
●PLA2G6(家族性パーキンソン病の原因遺伝子の1つ)の病理検討においてミトコンドリアの内膜にαシヌクレインがかなり増えていることを報告したが、神経細胞死は確認できなかった。
●PARK4のiPS細胞を使った研究でαシヌクレインの発現が高いという報告もある。
●ミトコンドリアの生合成を高めることによって細胞死を防げることも明らかにされている。
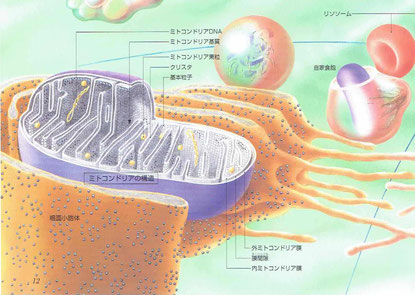
ミトコンドリアは船型の小器官で、内外2層の膜で包まれ内膜はクリスタに移行しています。クリスタの膜上には径9~10nmの基本粒子がぎっしり配列しており、ADPとリン酸からATPを合成します。
画像出展:「細胞と組織の地図帳」
3.オートファジー・リソソーム系の障害
・タンパク質分解系、特にオートファジー・リソソーム系の障害が関っているのではないか。
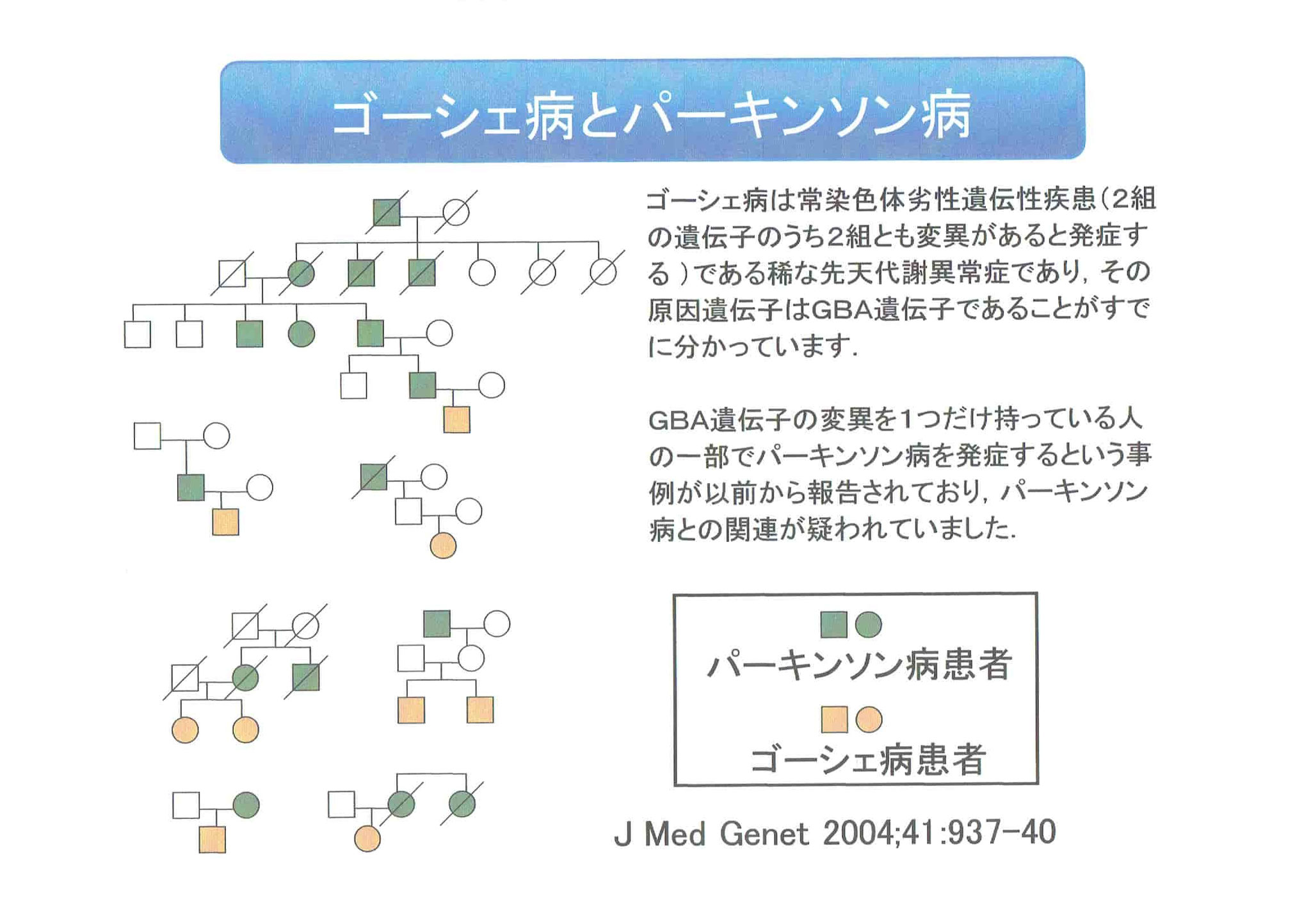
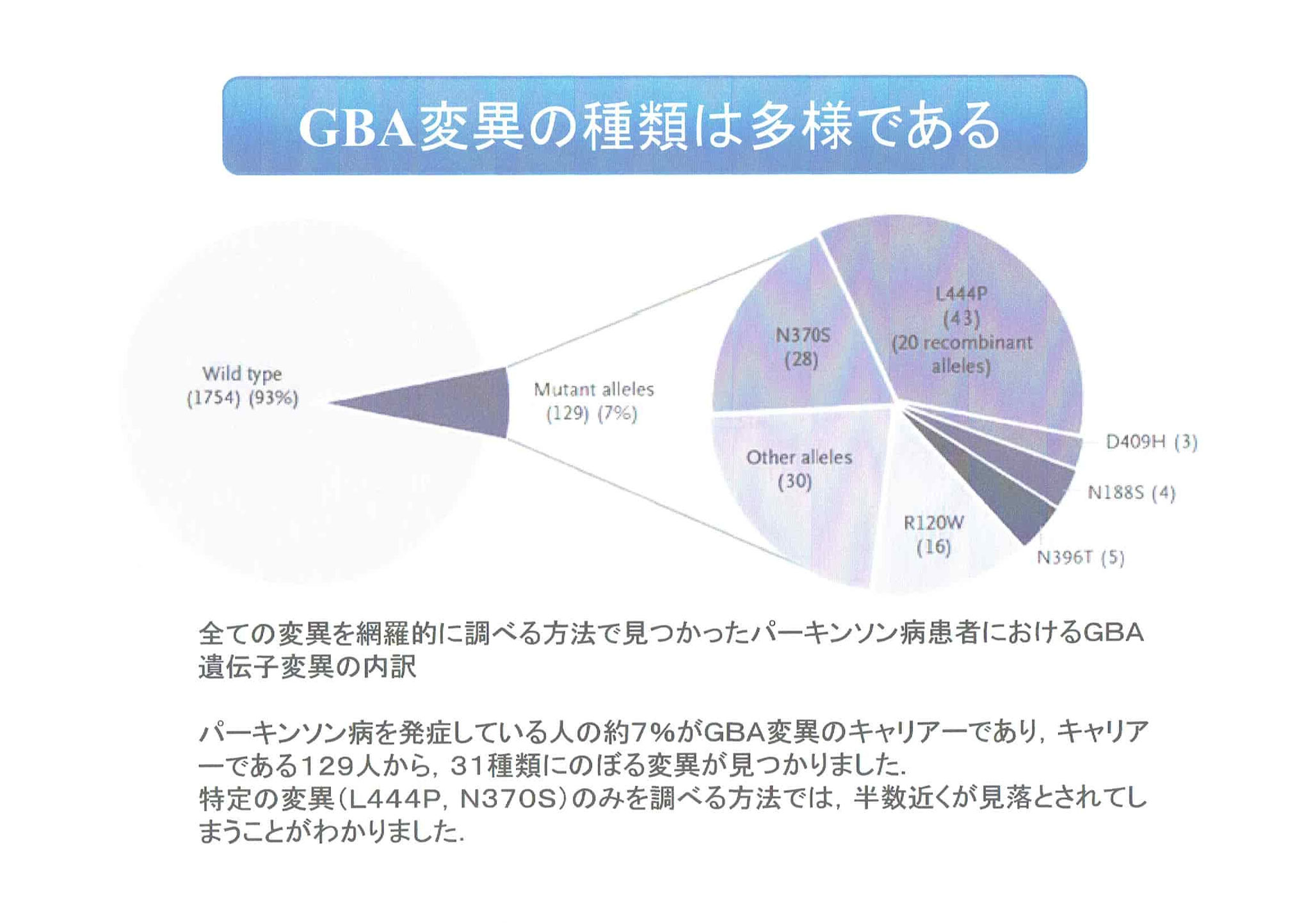
・オートファジー・リソソーム系の障害が注目されるようになったのは、ゴーシェ病というリソソーム蓄積病として有名な先天性代謝異常症の疾患遺伝子であるGBA変異遺伝子が、孤発性パーキンソン病の大きなリスク因子であることが示されたことによる。
・GBA遺伝子変異を持つ人は持たない人に比べ5倍以上パーキンソン病を発症しやすい。
・リソソームの異常が孤発性パーキンソン病を引き起こすのではないかという強い遺伝的な証拠が出された。
【スライドショー】
下記はネット上にあった資料をお借りして、スライドショーにしました。スライドは11枚で8秒で次のスライドに切り替わります。また、停止させることも可能です。
題名:パーキンソン病の発症に関連する重要な遺伝的因子を発見・確立 ~大規模国際多施設共同研究により、人種によらないパーキンソン病の最も重要な遺伝的因子を発見・確立
下記の絵で見て頂きたいのは、リソソームです。左の絵をクリックし拡大して頂くと、先にご紹介したミトコンドリアの上方に[異物や老廃物の消化分解]としてリソソームが変化していく過程が出ています。
DMT(disease modifying therapy:疾患修飾療法)
●αシヌクレインの凝集・ミトコンドリアの品質管理障害・オートファジー・リソソーム系の障害の3のことを踏まえて、我々は新たなDMTを開発しなければならない。
●現在、パーキンソン病の症状改善をもたらす対症療法は大変発達している。
●DMTはどのようなものが良いのかを考えると、最も直接的に考えられることはαシヌクレインの毒性を何とか消せないかということ。
●αシヌクレインを減らす治療薬として、αシヌクレイン抗体がある(大手製薬会社で開発中)。また、転写制御も治療薬の候補である。
●現在、αシヌクレインを減らすという方向で、核酸医薬(DNAやRNAといった遺伝情報を司る物質「核酸」を医薬品として利用するもの)が開発されている。
●スクリーニングで見つけた最適な核酸医薬をαシヌクレインのトランスジェニックマウスの脳室に投与し、運動機能の改善を認めている。現在は大型動物で有効性、安全性などの長期試験の検討が進められている。
※トランスジェニックとは:外部から特定の遺伝子を受精卵に注入して発現させること。各種の疾患モデルマウスの作製等に応用されている。
●パーキンソン病にはいろいろなタイプがあるので、ターゲットをPARK4(αシヌクレインduplication:αシヌクレインの遺伝子重複がある家系)の患者として、希望があれば治験を進めている。
●現在は、核酸医薬の他、抗体治療が世界的に行われている。
●発症したときには既にドパミン神経細胞が大分減ってしまっているので、発症してしまった患者にDMTができるのかという大きな課題がある。
●核酸医薬にしても、抗体医薬にしても、バイオマーカーを用いて効果の確認を取る必要がある。現在、この問題は難問となっているが、ミトコンドリアの代謝に関係するものが重要なマーカーになるのではないか。
●抗体医薬のバイオマーカーとしては、抗体医薬は全身に投与するので、例えば腸でバイオプシー(生検:試験切除)をして、そこでαシヌクレインが減っているかどうかを見るということも可能かもしれない。
※バイオマーカーに関する話(引用):『アルツハイマー病のアミロイドβ(Aβ)タンパク質に対する抗体治療で、バイオジェン(神経疾患、神経変性疾患の治療法開発に重点を置く、世界屈指のバイオテクノロジー会社)の作ったaducanumabという抗体に効果があるという報告が2016年9月の「Nature」に出て、非常に大きなインパクトがありました。Aducanumabの場合は、蓄積したアミロイドを可視化するPETがすでに開発されていたので、治療を行うことによってアミロイドが減っていることが画像からも示されました。症状の変化もありますが、それにプラスして画像によって評価ができるということが、アルツハイマー病においては非常に強力な武器になっていると思います。』
発症前診断・発症前治療の課題
●海外ではアルツハイマー病の患者への対応と同様に、遺伝的な疾患の可能性のある患者さんを早期に診断する、いわゆる発症前診断や発症前治療をどんどん進めている。それは日本では倫理的な問題があり、非常に大事な点である。(これは、発症していないのに将来パーキンソン病になるとわかってしまうことが、非常に大きな問題になるということです)
●全家系について調べたデータでは、αシヌクレイン duplication(PARK4)の浸透率は約33%。これは遺伝子変異を持っているとパーキンソン病になる確率が33%という意味。発症する確率は家系によって違う。
●PARK4の家系は全世界で約60家系、日本では10家系位。発症しない人もおり、その人に治療するわけにいかない。
●現在、海外ではアルツハイマー病治療薬の治験で発症前診断が行われている。発症前治療の二重盲検試験(区別のつかない偽薬を用いて効果の差をみること)が海外では進んでいる。日本ではどうするのか。確かに難しい問題だが、それを乗り越えていかないとDMTは実現しないかもしれない。
●PARK4の患者は進行が早く、パーキンソン病の発症があればほぼ100%が認知症に移行する可能性高い。
弧発性パーキンソン病への展開
●PARK4を対象とした新しい治療が生まれたとして、これを弧発性パーキンソン病に広げていくためにはどうすればよいのか、理想的には前駆期パーキンソン病がきちんと診断できるようになれば、その時期から治療が可能になるのではないか。
●前駆期パーキンソン病の位置付けということに真剣に取り組まなければならない。
●RDB(REM睡眠行動障害)は前期パーキンソン病としてとらえていいのかどうかということもある。多くの疫学調査で、RBDの80%以上が数年以内、長いケースでも16年ぐらいでパーキンソン病になるということからすれば、RBDが良いターゲットになると思う。
●腸の連関現象がすごく重要。2016年、『Cell』にgerm freeとパーキンソン病由来のマイクロバイオータではパーキンソン病モデルの進展が大きく異なると発表された。専門家の間では賛否両論。もし、腸をターゲットにできれば高分子の治療薬も投与可能になる。
分かったこと
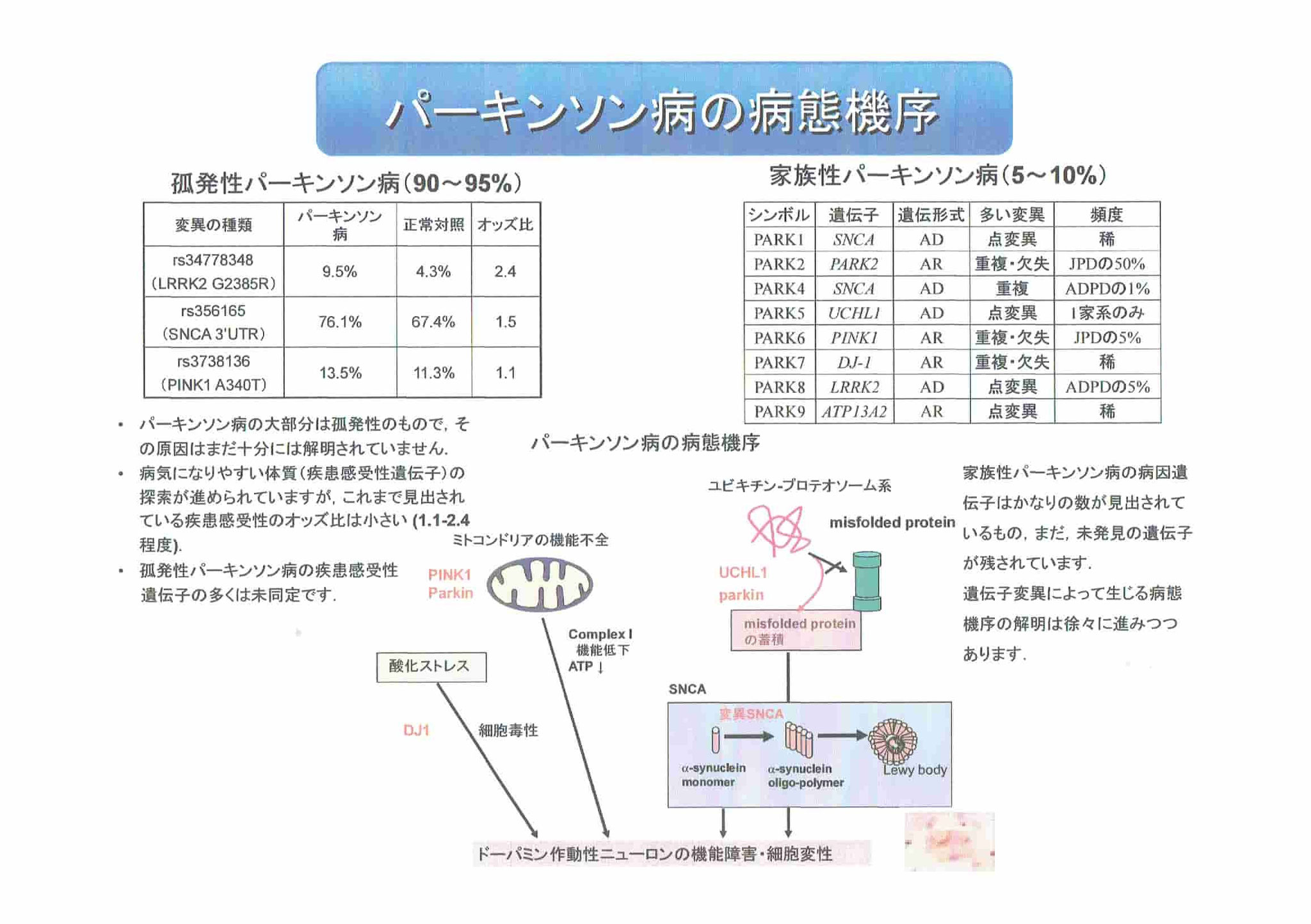
●遺伝的要因による家族性パーキンソン病は10%以下、ほとんどのパーキンソン病は弧発性パーキンソン病と呼ばれるものである。
●家族性パーキンソン病では、αシヌクレインという遺伝子が関わっている。
●家族性パーキンソン病では、ミトコンドリアの品質管理機能の破綻が関わっている。
●弧発性パーキンソン病では、GBAという遺伝子の変異が大きなリスク因子であり、特にリソソームの異常が関わっていると考えられている。
αシヌクレインの問題は、フォールディング異常によるものとされており、その原因は熱、細菌感染、炎症、活性酸素、紫外線、飢餓、低酸素状態などのストレスと言われています。
炎症とはウィルスなどとの戦い、戦火に包まれた戦場です。(参考「慢性炎症」)

「戦いの真っただ中」:白血球が侵略者を僕滅させます。
地上部隊の白血球は、その役割ごとに主に4つの小隊に分かれています。
・B細胞:特殊なタンパク質から抗体とよばれる武器を使って、バクテリア、ウィルス、毒素を捕らえ悪行を阻止します。
・好中球:寿命が3日しかない好中球は短期決戦になります。武器は強力な活性酸素で、あたかもクラスター爆弾のように周囲に存在するすべてを抹殺します。
・マクロファージ:食細胞といわれるマクロファージは大蛇のように、侵略者に近づいて一気に飲みこみ、活性酸素や酵素を使って分解してしまいます。
・T細胞:血液中に逃亡したり、組織の中に潜む侵略者を追跡し、容赦なく破壊します。まるでSWATのような働きですが、状況によってはより適した白血球に援軍を要請することもあります。
「戦い終わって」これは治癒の段階です。病原体と免疫との戦いで体が受けた損傷を治癒させます。この局面が健康を維持する鍵となります。
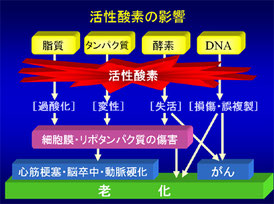
活性酸素は強力な武器です。しかしながら、次のような大きな課題を持っています。
『感染や炎症によってマクロファージや好中球が活発化し、ロケット弾である活性酸素を敵めがけて発射する。しかし、この活性酸素が敵ばかりでなく、細胞の内部に存在するDNAにも損傷を与えてしまう。これは、戦場で味方の砲撃によって犠牲者が出てしまう“友軍放火”の生物版といえる。』
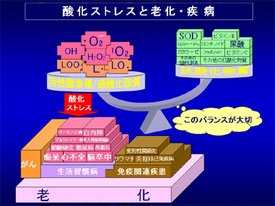
熱、細菌感染、紫外線、飢餓、低酸素状態の各ストレスは一般的とは言いがたく、最も注目すべきは活性酸素(炎症を含む)ではないかと思います。
αシヌクレインの問題では、特に活性酸素が重要ではないかとお話しましたが、ミトコンドリアはエネルギー産生時に活性酸素を作ってしまうという問題点を抱えています。さらにリソソームも同様に活性酸素を産生するようです。万一、ミトコンドリアやリソソームが暴走し大量の活性酸素を産生するようなことが起きれば、それは由々しき問題につながります。
宿題
今回の勉強で最も気になったことは、パーキンソン病の主因の一つに活性酸素の問題があるということです。(何度も、太赤字でマークしてしまいました)
一方、鍼灸治療の効果は、「筋肉などの軟部組織を緩め、血液循環を良くすること。自律神経を調え、免疫力を高め、患者さま本来の自然治癒力を手に入れること。」と考えており、活性酸素については直接的というより間接的に働きかける何かがあると考えます。
それを見つけるには、活性酸素あるいは酸化ストレスについて学習する必要があるため、適したテキストを探し出そうと、しつこくネット検索を続けました。そして、下記のような非常に興味深い本を見つけることができました。
追記(2018年1月21日)
患者さまの中で年始に転倒。お話を伺うといくつかパーキンソン病/パーキンソン病症候群が疑われる所見をお持ちだったため、診察内容などを説明した「親切で分かりやすいサイト」はないかと探していた時に見つけたものです。なお、このサイトは大日本住友製薬さまが運営されています。