『パーキンソン病-進化する診断と治療-』という特集は【座談会】で始まっています。【基礎】は2番目であり、掲載されていた寄稿は次の4つです。
●「大脳基底核の機能とドパミン神経の役割」
●「パーキンソン病の動物モデル」
●「αシヌクレイン細胞間伝播と疾患修飾療法」
●「iPS細胞を用いたパーキンソン病研究」
ブログでは、「αシヌクレイン細胞間伝播と疾患修飾療法」と「iPS細胞を用いたパーキンソン病研究」の2つを取り上げました。前者はαシヌクレインという機能不明のタンパク質がパーキンソン病発症のキーワードの1つであること、後者は注目度の高いiPS細胞による研究であることが、その理由です。
なお、分からない用語が数多くあったため、それらの用語の後ろに( )で説明等を付け加えましたが、その結果少し見づらくなっていると思います。
要旨:『パーキンソン病をはじめとする神経変性疾患において、従来、異常凝集タンパク質の蓄積とこれに続く神経変性は、個々の神経細胞においてそれぞれ独立して起こるものと推定されてきた。一方、異常凝集タンパク質がプリオンのように細胞間を伝播し病変を拡大させるという細胞非自律的な病態機序が近年提唱され、病態概念が大きく変化してきている。プリオン様伝播は疾患修飾療法(進行を遅らせる治療法)のターゲットとしても注目を集めている。』
パーキンソン病分子病態のculprit(原因) -αシヌクレイン(αSYN)-
・αシヌクレインはタンパク質凝集体であるレビー小体の主成分であるが、レビー小体はパーキンソン病の他、レビー小体型認知症やレム睡眠行動障害の患者脳内にも見られ、多系統萎縮症(MSA)ではオリゴデンドログリア(中枢神経系内のグリア細胞の一つで髄鞘形成を担う)内に凝集αSYN蓄積が認められる。これらの異常凝集αSYN沈着を共通病理とする神経変性疾患は、シヌクレイノパチー(リン酸化αシヌクレインが脳内に蓄積する疾病)と総称される。
・ヒトαSYNは140アミノ酸からなる機能不明のタンパク質で、神経細胞のシナプス前末端の他、赤血球に高発現している。
・αSYNは専ら細胞内で機能するタンパク質と考えらえてきたが、神経細胞内に存在するαSYNの一部は細胞外に分泌されることが確認されている。
・αSYNは、αらせん構造をとり生体膜に結合するか、あるいは不定の構造をとり細胞質に存在していると推定されるが、点変異(DNAやRNAのグアニン[G]、アデニン[A]、チミン[T]、シトシン[C」のうち一つの塩基が別の塩基に置き換わってしまう突然変異のこと)や酸化的ストレスなど種々ストレス下にてクロスβシート構造(タンパク質の二次構造の一つであるβシートが積層して沈着しているもの)に富むアミロイド(ある特定の構造を持つ水に溶けないタンパク質)様線維を生じる。
・αSYN線維化の過程で生じる中間産物(オリゴマー、プロトフィブリ)は、酸化的ストレス、小胞体ストレス(小胞体内のカルシウム枯渇、細胞への酸化ストレス、変異タンパク質の発現、低グルコース状態や低酸素状態などの生理的ストレス)、ミトコンドリア障害、小胞輸送障害、シナプス機能不全、神経炎症などさまざまな細胞障害を惹起し、神経細胞死に積極的に関与していることが知られている。
In vivoモデル(生体内モデル)を用いたαSYN伝播現象の検証
・αSYN伝播経路に関しては、接種部位を変えると病理の出現部位も変化することや、接種部位と線維連絡のある領域に病理が確認されやすいことから、神経回路を介している可能性が示唆されている。
αSYN吸収・分泌・分解を制御する細胞内輸送機構
1.αSYN取り込み機構について
細胞外環境からのαSYN取り込み経路に関しては、エンドサイト―シス(食作用[固体を取り込む現象])、ピノサイト―シス(飲作用[溶液を取り込む現象])、細胞間ナノチューブトンネル(細胞小器官あるいは直接的な細胞膜貫通[膜を介した物質輸送])など、複数の可能性が推定されている。
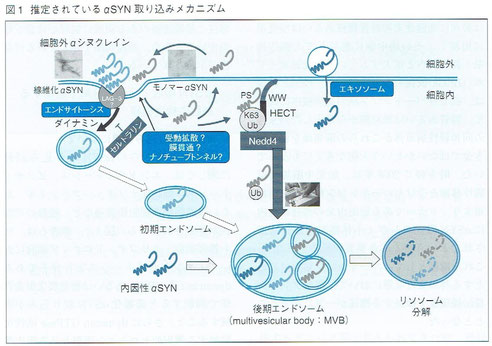
線維化αSYNは主にエンドサイトーシス経路(左上端)により取り込まれる。一方、モノマーαSYNは細胞膜を貫通し(エンドサイト―シス右横)、細胞内外を行き来している。このほか、プリオンと同様にエキソソーム(右上)を介したαSYN取り込みの可能性も示唆されている。
2.αSYN分泌機構について
・αSYN分泌におけるエキソソーム(細胞外小胞)の関与については賛否両論があり、一定の結論は出ていない。
・αSYN分泌経路は細胞のストレス状況によって左右される可能性がある。
・パーキンソン病関連遺伝子の一部がαSYN分泌に影響していることを示す興味深い報告が散見される。
・Baeらは、パーキンソン病発症リスク遺伝子であるGBAの欠損が、リソソーム障害とともにαSYN分泌および細胞間伝播を促進することを報告している。
・Tsunemiらは、家族性パーキンソン病であるPARK9原因遺伝子ATP13A2が、αSYNのエキソソーム分泌を制御している可能性を示している。
3.αSYN分解におけるリソソーム機能の重要性
・αSYN分解にはリソソーム/オートファジーが重要な役割を担っていると考えられている。
・パーキンソン病病態におけるエンドソーム(食作用、飲作用によって細胞内に形成される小胞)、リソソーム機能の重要性は、LRRK2、ATP13A2、VPS35.RAB7L1、DNAJC13、GBAなど家族性パーキンソン病・パーキンソン病リスク遺伝子の多くが同機構の制御分子であることからも容易に推測される。
異常タンパク質伝播を標的とした疾患修飾療法
・パーキンソン病に対する現行の治療はドパミン補充療法を主体とした対症療法であり、同治療により患者の機能・生命予後が飛躍的に改善したという事実は、神経変性疾患治療の歴史における偉大なマイルストーンと言える。近年注目されているiPS細胞を用いたドパミン産生神経細胞の移植治療に関しても、基本コンセプトはドパミン補充であることに変わりはない。
・細胞間を伝播するαSYNをターゲットとした進行抑制治療への足掛かりとして、αSYN抗体・ワクチン療法治験が進行中である。
むすび
『αSYN細胞間伝播は、Braakが提唱したレビー小体病理の topographic progression
の理論的根拠としておおむね受け入れられつつある。さらに、腸管あるいは鼻粘膜からの病理進展説に関しても、消化性潰瘍に対して迷走神経遮断術を受けた例で将来のパーキンソン病発症率が半減していたという結果や、嗅覚障害がパーキンソン病発症リスク因子であるとの疫学研究の結果など、支持的証拠が示されている。ごく最近では、パーキンソン病患者由来の腸内細菌叢が、中枢神経におけるレビー小体病理形成や運動症状発現に関与していることを示唆する興味深い研究結果も報告されている。異常タンパク質伝播現象の背景にある分子メカニズムが徐々に明らかにされる中で、異常凝集タンパク質蓄積を共通病態とする神経変性疾患の進行抑制治療薬の開発が進むことを願いたい。』
コメント(自分なりに整理してみました)
αシヌクレインが脳内に蓄積する疾病をシヌクレイノパチーと呼んでいます。当初、異常凝集のαシヌクレインは細胞内で機能するものと考えられていましたが、それは誤りであり、細胞外に伝播するということが明らかになりました。そして伝播経路については神経回路を介している可能性があります。
細胞外環境からのαシヌクレイン取込み経路に関しては、複数の可能性が考えられ、αシヌクレイン分泌経路に関しては、細胞のストレス状況によって左右される可能性も指摘されています。さらに、分解にはリソソーム/オートファジーが重要な役割を担っていると考えられています。
現在、細胞間を伝播するαシヌクレインをターゲットとした進行抑制治療への足掛かりとして、αSYN抗体・ワクチン療法治験が進行中です。
異常タンパク質伝播現象の背景にある分子メカニズムが徐々に明らかにされる中で、異常凝集タンパク質蓄積を共通病態とする神経変性疾患の進行抑制治療薬の開発が進むことが期待されています。
要旨:『人工多能性幹細胞(iPS細胞)を用いた疾患研究は、患者の生体内の変化を実験室内で知るために有用な手法である。現在、神経疾患を中心にiPS細胞を用いた研究報告数が増加している。本稿では、iPS細胞を用いたパーキンソン病研究を中心に述べる。』
はじめに
・iPS細胞は皮膚線維芽細胞や単核球などの体細胞に少数の細胞初期化因子を導入することにより作製され、多分化能と、ほぼ無限に増殖できる能力を持つ。
・体細胞由来であることからES細胞(胚性幹細胞)と比較して倫理的課題が少ない(この倫理的課題とは、「人の生命の萌芽」であるヒト胚を滅失させること。生殖細胞(精子・卵子等)への分化を通じて個体の生成に結びつき得る。ということのようです)。そのため、目的の細胞に分化誘導し、病態研究、創薬研究、再生医療等、さまざまな研究に活用されている。
神経疾患における疾患特異的iPS細胞研究
・モデル動物を用いた解析では、その結果が必ずしもヒトにおいて反映されないという課題があったが、ヒトiPS細胞はその課題を取り除いた。
・iPS細胞樹立の翌年2008年には、パーキンソン病、ハンチントン病、筋ジストロフィーを含むいくつかの神経疾患患者から、疾患特異的iPS細胞の樹立が報告された。
疾患特異的iPS細胞を用いたパーキンソン病研究
・パーキンソン病は、アルツハイマ―病に次いで患者の多い神経変性疾患である。
・ドパミン神経細胞を疾患標的細胞としたiPS細胞研究が数多く報告されている。
・パーキンソン病患者の約10%が家族性とされ、これまで報告された疾患特異的iPS細胞を用いたパーキンソン病研究のほとんどは、家族性パーキンソン病患者を対象としたものである。

この表の[モデリング・解析例]を見て気付くことは、10例中4例に[酸化ストレス]が入っていること。また、[αシヌクレイン]と[ミトコンドリア]がそれぞれ2例ずつ入っていることです。前回のブログの宿題として、活性酸素の理解を自らに課しましたが、酸化ストレスは活性酸素と抗酸化システムとのバランスとして定義されますので、酸化ストレスの理解も活性酸素同様、きわめて重要です。
画像出展:「最新医学」
おわりに
『パーキンソン病研究は、iPS細胞技術により病態解明や創薬開発等において多くの進展が見られている。現在のところ、疾患特異的iPS細胞を用いたパーキンソン病研究の中心は、単一遺伝子を原因とする家族性パーキンソン病である。長期培養によって、孤発性パーキンソン病においても遺伝性パーキンソン病と同様にドパミン神経細胞で疾患表現型の一部を再現した報告もあるが、現在の培養条件で発症に数十年を要する神経変性疾患の細胞変化を再現できるかは、議論が分かれるところである。プロジェリン(早老症にみられる変異タンパク質)導入によって老化現象の再現を試みた報告もあるが、今後はより生理的な細胞の経時的変化や環境因子を忠実に再現できる培養技術の開発が期待される。』
コメント(自分なりに整理してみました)
2008年にはパーキンソン病に関しても、疾患特異的iPS細胞の樹立が報告されました。そして、現在ではドパミン神経細胞を疾患標的細胞としたiPS細胞研究が数多く報告されています。しかしながら、これまでの報告は10%以下と考えられている家族性パーキンソン病患者を対象としたものになっており、孤発性パーキンソン病に対する研究にも強い期待が寄せられています。 注)本が出版された2009年9月以前における状況です。




